Dans une étude récente publiée dans le bioRxiv*serveur de préimpression, les chercheurs fournissent la première preuve préclinique de l’utilité des antagonistes du récepteur 183 couplé aux protéines G (GPR183), également connu sous le nom de gène 2 induit par le virus d’Epstein-Barr (EBI2), dans la réduction de la maladie par le coronavirus 2019 (COVID – 19) gravité.
 Étude : Les oxystérols entraînent une inflammation via GPR183 lors d’une infection par le virus de la grippe et le SRAS-CoV-2. Crédit d’image : Andrii Vodolazhskyi/Shutterstock
Étude : Les oxystérols entraînent une inflammation via GPR183 lors d’une infection par le virus de la grippe et le SRAS-CoV-2. Crédit d’image : Andrii Vodolazhskyi/Shutterstock
Arrière plan
L’infection par le virus de la grippe A (IAV) et le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) entraîne la production de cholestérols oxydés ou d’oxystérols, tels que le 7α,25-dihydroxycholestérol (7α,25-OHC), qui sont des marqueurs d’inflammation pulmonaire.
Des études ont montré que l’exposition aux allergènes augmente les oxystérols dans le liquide de lavage bronchoalvéolaire (BALF). Elle est également augmentée dans les crachats des patients atteints de maladie pulmonaire obstructive chronique (MPOC). Cependant, les études n’ont pas étudié l’inflammation pulmonaire induite par l’oxystérol après des infections respiratoires virales.
Le GPR183 exprimé dans les macrophages est un composant cellulaire clé des systèmes immunitaires inné et adaptatif. Associé à ses ligands oxystérols, le GPR183 facilite la distribution des cellules immunitaires aux organes lymphoïdes secondaires. Par conséquent, le blocage de GPR183 à l’aide d’antagonistes pourrait être thérapeutiquement bénéfique pour réduire l’inflammation pulmonaire liée au COVID-19 et la gravité de la maladie.
À propos de l’étude
Dans l’étude actuelle, les chercheurs ont utilisé deux modèles murins précliniques d’infection par l’IAV et le SRAS-CoV-2 pour démontrer l’infiltration de macrophages induite par l’oxystérol GPR183 dans les poumons, qui peut être mortelle. Cela peut entraîner une tempête de cytokines, des lésions graves des tissus pulmonaires, un syndrome de détresse respiratoire aiguë (SDRA) et la mort à la suite d’infections virales, y compris les infections à l’IAV et au SRAS-CoV-2.
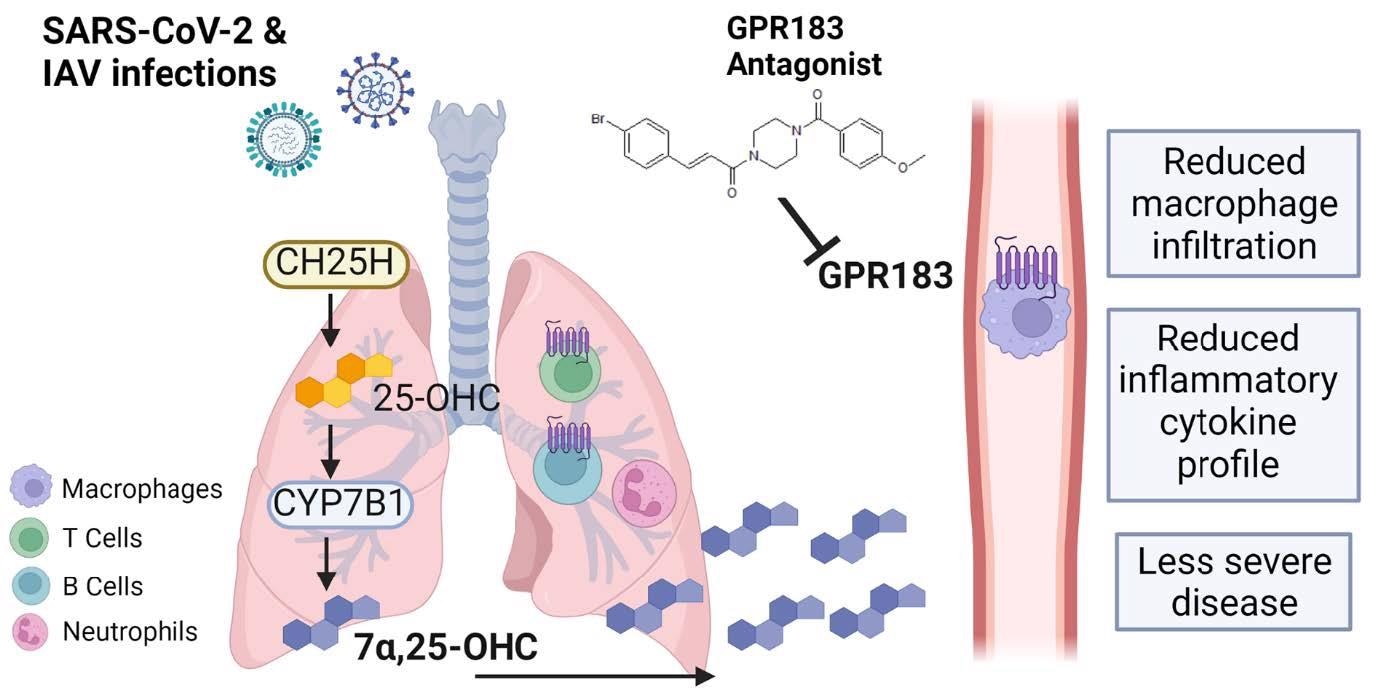
Figure schématique du rôle de GPR183 dans la réponse immunitaire aux infections par le SRAS789 CoV-2 et l’IAV. Les infections par le SRAS-CoV-2 et l’IAV entraînent une régulation positive du CH25H et du CYP7B1, entraînant la production de 7a,25-OHC. Cet oxystérol attire chimiotactiquement les macrophages exprimant GPR183 vers les poumons, où ils produisent des cytokines pro-inflammatoires. L’inhibition pharmacologique de GPR183 atténue l’infiltration des macrophages exprimant GPR183, réduisant la production de cytokines inflammatoires sans affecter négativement les réponses antivirales.
L’équipe a infecté des souris avec l’IAV et déterminé l’expression de l’acide ribonucléique messager (ARNm) des enzymes productrices d’oxystérol cholestérol 25-hydroxylase (CH25H) et 25HC 7α-hydroxylase (CYP7B1) dans leurs poumons. De même, ils ont infecté des souris avec une souche de SRAS-CoV-2 adaptée à la souris en faisant passer la variante bêta quatre fois chez des souris C57BL/6J. Ils ont également réalisé des expériences sur des souris génétiquement déficientes en GPR183 (Gpr183-/-).
L’équipe a administré un antagoniste synthétique du GPR183 (2E)-3-(4-Bromophényl)-1-[4-(4-methoxybenzoyl)-1-piperazinyl]-2-propène-1-one (NIBR189) chez des souris C57BL/6J deux fois par jour à partir de 24 h après l’infection jusqu’à la fin de l’expérience. De plus, ils ont effectué des analyses de cytométrie en flux sur des suspensions de cellules pulmonaires individuelles de souris C57BL/6J et Gpr183-/- traitées respectivement avec NIBR189 et le véhicule. De plus, les chercheurs ont cherché à savoir si une infiltration réduite de macrophages et un profil de cytokines inflammatoires dans les poumons de souris traitées au NIBR189 étaient associés à des charges virales altérées, mesurées par l’expression de la protéine de nucléocapside (Np).
Résultats de l’étude
Semblable aux résultats de l’infection par l’IAV, l’expression de l’ARNm du CH25H et du CYP7B1 a été considérablement augmentée dans les poumons des souris infectées par le SRAS-CoV-2. IHC a en outre confirmé ces résultats au niveau des protéines. De plus, les souris déficientes en Gpr183 avaient une infection par le SARS-CoV-2 moins sévère. Deux jours après l’infection, les homogénats de poumon de souris avaient des concentrations élevées de 7α,25-OHC. De plus, les souris C57BL/6J traitées au NIBR189 ont perdu moins de poids, ont récupéré plus rapidement et ont considérablement réduit l’infiltration des macrophages pulmonaires à deux et cinq dpi par rapport aux souris C57BL/6J infectées par le véhicule. Bien que le traitement NIBR189 n’ait pas affecté les réponses IFN précoces, les réponses IFN à cinq dpi étaient significativement plus faibles.
L’expression de SARS-CoV-2 Np n’a pas été détectée à cinq jours par pouce lorsque les animaux se sont remis de l’infection. Cependant, au niveau de l’ARNm, les charges d’ARN de la protéase majeure du SRAS-CoV-2 (Mpro) dans les poumons des souris traitées au NIBR189 étaient significativement plus faibles à cinq dpi. Dans l’ensemble, les résultats de l’étude ont indiqué que les antagonistes du GPR183 réduisaient les charges virales, l’infiltration de macrophages et la production de cytokines pro-inflammatoires.
Les interférons précoces (IFN) de type I et III sont cruciaux pour contrôler la réplication virale lors des infections par l’IAV et le SARS-CoV-2. Inversement, les réponses IFN de type I persistantes peuvent être préjudiciables à l’hôte et contribuer au développement de tempêtes de cytokines. Une production plus faible de cytokines pro-inflammatoires chez les animaux traités au NIBR189 a indiqué de bons résultats pour la maladie et une clairance virale plus efficace. En particulier, contrairement au 7α,25-OHC, qui inhibe l’infection par le SRAS-CoV-2 in vitro En bloquant la fusion de la membrane de la cellule hôte et du virus, car il est structurellement différent des cholestérols, NIBR189 ne modifie pas la composition de la membrane de la cellule hôte.
conclusion
L’étude actuelle a démontré les doubles avantages de l’antagoniste GPR183 NIBR189. Premièrement, NIBR189 a réduit l’infiltration de macrophages et la production de cytokines inflammatoires dans les poumons d’animaux infectés par l’IAV et le SRAS-CoV-2. Cependant, uniquement chez les souris infectées par le SRAS-CoV-2, NIBR189 a considérablement amélioré la gravité de l’infection en abaissant la charge virale. De plus, l’utilisation à court terme d’un antagoniste du GPR183 au cours d’une infection virale aiguë n’a pas eu d’impact négatif sur les réponses en anticorps. Plus important encore, une thérapie basée sur un antagoniste du GPR183 pourrait s’avérer efficace contre les variantes émergentes du SRAS-CoV-2 sans autre adaptation car elle cible l’hôte, pas le virus. Cependant, une enquête plus approfondie est nécessaire pour déterminer pourquoi NIBR189 n’a eu aucun impact sur les charges virales IAV et si cela était dû à l’agent pathogène ou à la gravité de l’infection.
*Nouvelles importantes
bioRxiv publie des rapports scientifiques préliminaires qui ne sont pas évalués par des pairs et ne doivent donc pas être considérés comme concluants, guider la pratique clinique/les comportements liés à la santé, ou être traités comme des informations établies.
- Les oxystérols provoquent une inflammation via GPR183 lors d’une infection par le virus de la grippe et le SRAS-CoV-2, Cheng Xiang Foo, Stacey Bartlett, Keng Yih Chew, Minh Dao Ngo, Helle Bielefeldt-Ohmann, Buddhika Jayakody Arachchige, Benjamin Matthews, Sarah Reed, Ran Wang, Matthew J. Sweet, Lucy Burr, Jane E. Sinclair, Rhys Parry, Alexander Khromykh, Kirsty R. Short, Mette M. Rosenkilde, Katharina Ronacher, bioRxiv preprint 2022, DOI : https://doi.org/10.1101/2022.06.14.496214,

