Le coronavirus-2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), l’agent causal de la pandémie de maladie à coronavirus 2019 (COVID-19), a infecté plus de 639 millions de personnes dans le monde et s’est propagé à plus de 6,6 millions de vies. Malgré le démarrage rapide des programmes de vaccination contre le COVID-19 dans la plupart des pays du monde, le virus est resté en circulation. Cela est principalement dû à l’émergence continue de nouvelles variantes du SRAS-CoV-2, telles que les souches Omicron et Delta, qui peuvent échapper aux réponses immunitaires induites par la vaccination et l’infection naturelle.
 Étude : L’analyse longitudinale unicellulaire des cellules B réactives au SRAS-CoV-2 révèle la persistance de clones spécifiques à l’antigène formés tôt
Étude : L’analyse longitudinale unicellulaire des cellules B réactives au SRAS-CoV-2 révèle la persistance de clones spécifiques à l’antigène formés tôt
Bas
De nombreuses études ont rapporté la génération de réponses immunitaires précoces après l’infection. Chez les patients gravement infectés par le COVID-19, une augmentation du nombre de cellules CD8 et CD4 de type Th1, de plasmablastes, de cellules érythroïdes et de mégacaryocytes a été détectée. De plus, des anticorps neutralisants (Abs) fixant les pointes (S) des isotypes IgA et IgG ont été trouvés au début de l’infection.
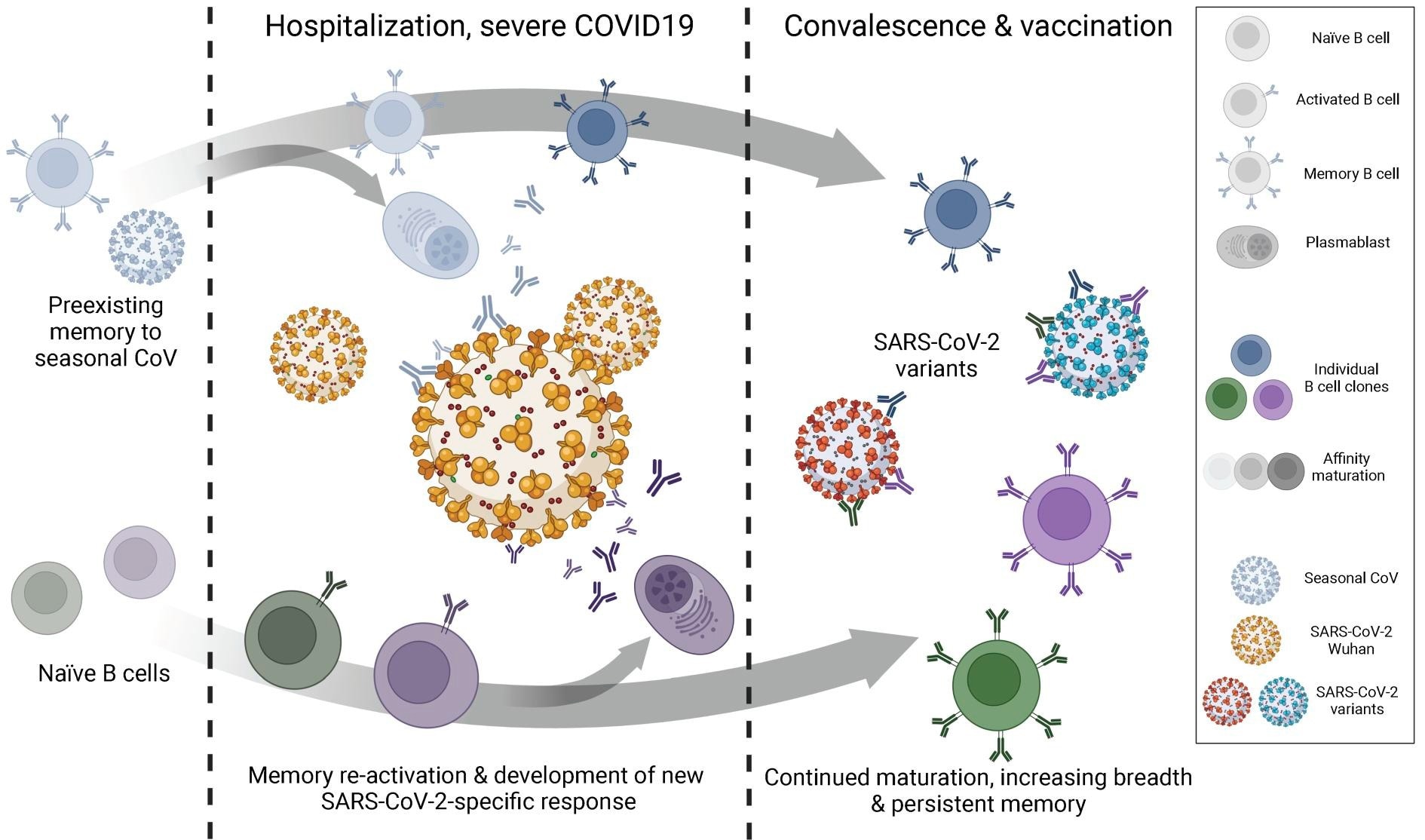
L’émergence des variantes du SRAS-CoV-2 a attiré davantage l’attention sur l’étude des cellules B mémoire (MBC). Des études sur des modèles animaux de la grippe ont indiqué que le groupe MBC possédait une plus grande étendue de liaison à l’antigène que la réponse plasmablastique. Cette découverte implique que les plasmocytes et les anticorps sériques protègent contre la réinfection avec la même souche virale, alors que le pool de MBC peut protéger contre un large éventail de variantes émergentes.
L’évaluation du développement de MBC après COVID-19 a révélé une augmentation continue des mutations du récepteur des cellules B (BCR), qui était en tandem avec la persistance de l’antigène et l’activité continue du centre germinal (GC). Ce nombre croissant de mutations a également amélioré l’amplitude de neutralisation du groupe MBC.
Le développement d’anticorps monoclonaux (mAb) clonés à partir de patients infectés par le SRAS-CoV-2 à différents points d’infection a révélé une ampleur neutralisante considérable contre les variants viraux. Cependant, la recherche longitudinale examinant la réponse immunitaire des mêmes patients pendant l’hospitalisation, après la guérison et après la vaccination fait défaut.
À propos de l’étude
une récente Perspective JCI L’étude a abordé cette lacune de la recherche et a utilisé une approche longitudinale pour fournir des informations importantes sur l’évolution des cellules B après des infections virales. Cette étude a recruté six patients gravement/gravement infectés par le SRAS-CoV-2 après leur admission à l’hôpital universitaire de Sahlgrenska, en Suède. Ils ont été suivis tout au long de la progression de la maladie et de la période de récupération pendant un an maximum.
Des échantillons de sang et de sérum des patients ont été prélevés tous les trois jours pendant l’hospitalisation. De plus, des échantillons après le congé ont été prélevés tous les trois mois pendant un an au maximum. Dans l’ensemble, 50 % de la cohorte de l’étude ont reçu le vaccin COVID-19 à la fin de la période de suivi.
Des échantillons ont été utilisés pour mesurer les cellules mononucléaires du sang périphérique total (PBMC) et les cellules B, sur la base de la transcriptomique unicellulaire, de l’expression des protéines de surface, de la liaison à l’antigène (Spike (S), Nucleocapsid (N) ou Receptor Binding Domain (RBD)), et BCR séquences, à chacun des instants analysés.
Résultats de l’étude
La conception de l’étude longitudinale a permis aux scientifiques de retracer l’origine des cellules B spécifiques de l’antigène et de comprendre leur schéma d’évolution chez chaque patient. Une modification significative des populations immunitaires circulantes a été observée au cours de l’infection. Au cours de la phase précoce de l’hospitalisation, des lymphocytes T CD4 avec de fortes signatures IFN ont été détectés, qui ont disparu dans les 3 mois.
Après 14 jours d’hospitalisation, la composition des cellules immunitaires ou les caractéristiques transcriptionnelles se sont stabilisées. Cependant, en raison de la petite taille de l’échantillon, il était difficile de tirer une conclusion ferme sur l’association entre les réponses immunitaires testées, les comorbidités et l’état immunitaire global.
Trois patients présentant des comorbidités respiratoires n’ont révélé aucune différence significative dans le nombre de populations différentes de cellules immunitaires ou de cellules B. En général, quels que soient le sexe, les comorbidités, l’âge et le statut immunitaire, une réponse immunitaire similaire a été observée chez tous les patients. .
Après l’infection par le SRAS-CoV-2, aucune expansion significative des clones de lymphocytes B n’a été observée ; des clones plus petits ont été détectés dans tous les échantillons à tous les instants, y compris le plasmablaste. Cependant, les plasmablastes précoces n’ont pas persisté tout au long de l’année, même après la vaccination. En particulier, les mAb du même patient, appartenant à la même famille clonale, ont acquis une capacité de liaison accrue à différentes variantes virales au fil du temps. Cette découverte implique une maturation persistante de l’affinité clonale en cours.
Notamment, après la récupération de COVID-19, une expansion significative de MBC a été observée avec une fréquence accrue de lymphocytes B spécifiques à l’antigène et une hypermutation somatique accrue parmi les liants. La vaccination contre le COVID-19 n’a pas accéléré ce processus. Les résultats de cette étude suggèrent que la vaccination n’était pas suffisante pour induire une forte expansion clonale et la réactivation du MBC dérivé de l’infection. Cependant, les données analytiques sur les sérums ont révélé qu’après la vaccination, il y avait une différenciation marquée des MBC en plasmablastes sécrétant des Ac.
Une analyse ontologique des gènes a révélé que le MBC à immunoglobuline commutée (swIg) possédait une signature transcriptionnelle activée plus élevée que le MBC IgM. De plus, on a constaté que les swIg-MBC spécifiques à RBD avaient une plus grande tendance à se réactiver lors de la réinfection.
conclusion
En résumé, l’étude actuelle a révélé la présence de clones persistants de COVID-19 qui ont été induits pour la première fois après l’infection. Ces clones ont été conservés jusqu’à un an pendant que leur capacité à retenir et à neutraliser la respiration s’améliorait. À l’avenir, davantage de recherches devraient être menées pour comprendre si des clones similaires peuvent être réactivés après vaccination ou réinfection.
- Scharf, L. et al. (2022) L’analyse longitudinale unicellulaire des cellules B réactives au SRAS-CoV-2 révèle la persistance de clones spécifiques à l’antigène formés tôt. Perspective JCI.


